第57回日本核医学会学術総会
脳血管障害における脳SPECTはこう使う
日時:2017年10月6日
場所:パシフィコ横浜
共催:東芝メディカルシステムズ株式会社
座長
神戸市立医療センター中央市民病院脳神経外科部長
坂井信幸先生
Diamox負荷脳血流SPECTは脳血管障害において、血行再建術の適応判定や周術期合併症予測などに有用な検査法であり、PETで測定される脳酸素摂取率(OEF)の代替としてよく用いられている。今回はその考え方と虚血性脳血管障害への応用について紹介する。
KEY SENTENCE
●IMP-SPECT画像における左右比はOEF上昇の判定のための指標となる。
●CCHを加味したIMP-SPECT画像における左右比によりDiamox負荷脳血流SPECTの適正使用指針につながる。
●過灌流予知のために、まず、MRAを用いることにより、Diamox負荷脳血流SPECTの使用を半数に減らすことが可能である。
虚血性脳血管障害におけるDiamox負荷脳血流SPECTの適正使用
虚血性脳血管障害においては、Diamox負荷脳血流SPECTが一般的に用いられており、血行再建術(バイパス術)の適応判定や過灌流症候群(頭蓋内出血やてんかん発作)など術後重篤有害事象の発生予測に有用とされている。しかし、2015年4月に公表されたアセタゾラミド(ダイアモックス注射用)適正使用指針では、文書による同意を含め造影検査と同様なリスク管理処置を行うこと、Diamoxの使用を必要最小限度にとどめることなどが注意点として示されている。
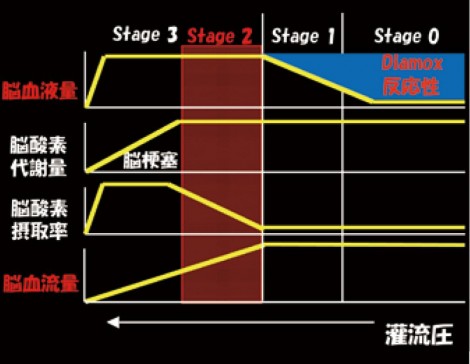
バイパス術の適応を考慮する際、灌流圧が下がると血管が拡張して血流を保つPowers分類のStage 1となり、さらに灌流圧が下がると脳血流(CBF)が低下する。ただし酸素代謝量(CMRO2)はすぐには下がらず代謝に対して血流が相対的に下がるという現象が起こる。この代謝を血流で割ったのが脳酸素摂取率(OEF)で、これが増加している状態がPowers分類のStage 2となる。したがって血行再建術の適応となるのは、OEFが上昇するStage 2と考えることができる(図1)。
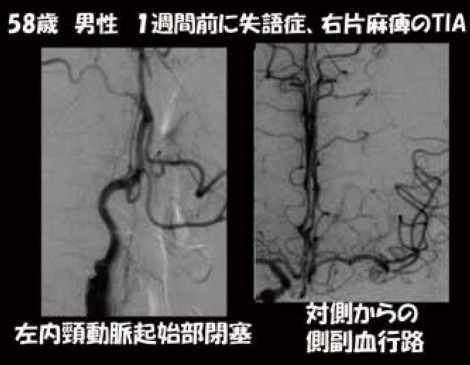
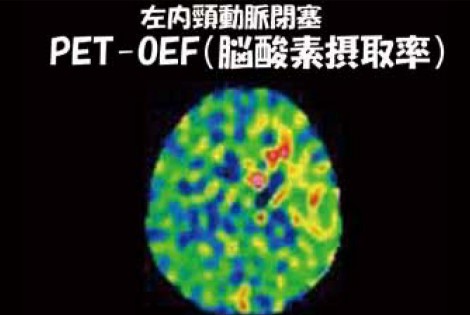
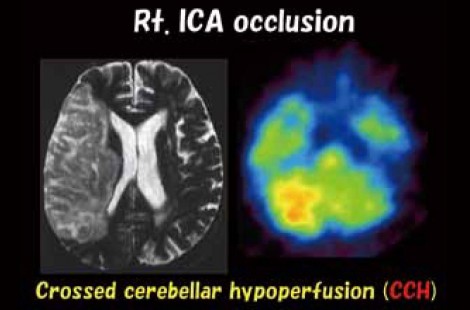
58歳男性の症例。1週間前に失語症と右片麻痺のTIAを発症。脳血管撮影を施行すると、左内頸動脈起始部の閉塞が確認された(図2)。このような場合、PETを撮像すると図3のような画像が得られ、将来的に脳梗塞の再発が予想される。
OEFの上昇は脳梗塞再発のハイリスクであることが多くの研究で示されているが、日常的にPET検査が実施できる施設は限られる。そこで、一般的に普及しているSPECTとDiamox負荷を用いることで、CBFとDiamox反応性(CVR)の関係性からStage分類を行っている。
図1では、CBFの低下とCVRの低下がStage2に相当すると考えられる。このような症例で本当に脳梗塞の再発を起こすのだろうか。これに関して、安静時CBFとCVRがともに低下している場合には、脳梗塞再発のハイリスクであることがこれまでの研究からも示されており、血行再建術の適応になると考えられる。
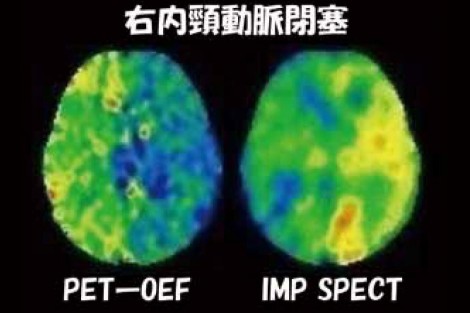
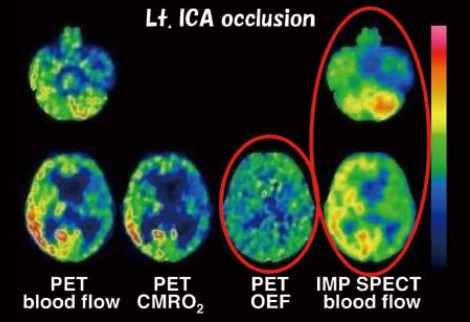
一方で、適正使用指針に記載されている「必要最小限の使用」にとどめる方法を考えなければならない。例えば、症候性の右内頸動脈閉塞症の患者でOEFが高い症例のIMP-SPECT画像では、患側の脳血流が低下していることが分かる(図4)。
図4 右内頸動脈閉塞のPET-OEFとIMP SPECT
図1のように、CBFが下がっていなければOEFが上がるはずがなく、一側性病変でOEFが高いということは、血流は低下していなければならない。そうであれば、一側性病変でOEFが高くなるためには、IMPSPECT画像上で明らかな左右差が認められると考えられる。 OEFの算出は一般病院では難しいため、OEF上昇を簡便に判定できる方法があれば非常に有用である。これは意外と単純なことで、IMP-SPECT画像において左右比を見ればよい。例えば一側性病変におけるStage 2は、大脳患側CBF/健側CBFが0.933以下であることが必要である。この方法により、定量値を確認せずに十分なスクリーニングができる。ただ、このうち実際にOEFが高いのは40%程度であるため、偽陽性が高くなってしまう。
次に、この精度を向上させる方法について考えてみたい。OEFは需要(CMRO2)に対する供給(CBF)の比である。仮にCMRO2がIMP-SPECTで把握できればOEFも算出することができる。例えば右内頸動脈閉塞症例の1カ月後のSPECTを撮影すると、対側の小脳半球の血流が落ちるcrossed cerebellar hypoperfusion(CCH) という現象が起こる(図5)。これは元々、cross cerebellar diaschisisという概念で、一側大脳半球のアクティビティーあるいは代謝が低下すると、対側の小脳半球のアクティビティーあるいは代謝が下がり血流量も低下するという現象である。つまり、健側の小脳半球の血流を見ることで、患側大脳半球の代謝の低下が類推できるということになる。
図5 Crossed cerebellar hypoperfusion(CCH)
図6 左内頸動脈閉塞症例におけるPETおよびIMP-SPECT画像
実際の症例で見てみると、例えば左内頸動脈閉塞症例ではIMP-SPECT で血流が患側大脳で低下しており、PETでも血流が低下していることが分かる(図6)。そしてCMRO2では患側大脳半球の酸素代謝が低下している。これを見ると、小脳半球の左右比は大脳半球の血流を見ているわけではなく、酸素代謝比を見ていると推測できる。実際にIMP-SPECT における小脳半球血流比と大脳半球の酸素代謝比には正の相関があることも分かった。したがって、小脳半球の左右比は大脳半球の酸素代謝比を表していると考えられる。そして、OEFは需要(CCHの程度)÷供給(CBF)という関係になる。少なくとも大脳半球の血流比にこれを加えることによって、精度が上がる可能性がある。縦軸にOEFの左右比をとると、偽陰性はなく、貧困灌流を判断できる。IMP-SPECT画像における左右比による一側性病変におけるStage 2の判定精度は40%であったのに対し、CMRO2を加味することにより70%まで精度が向上する。そして小脳半球血流比/大脳半球血流量が1.1以上であれば70%がStage 2だということも分かる。これらのことから、CMRO2を加味したIMP-SPECT画像における左右比により貧困灌流が示唆される症例のみに対してDiamox負荷脳血流SPECTを実施することで、適正使用指針に記載されていたような最低限の実施が可能になると考えられる。ただしこの方法には条件があり、発症から3カ月以内あるいは内包に梗塞巣がないことが原則となる。また、同様のスクリーニングはECDSPECTでも判定可能だと考えられる。
頸動脈内膜剥離術および頸動脈ステント術後の過灌流の予測
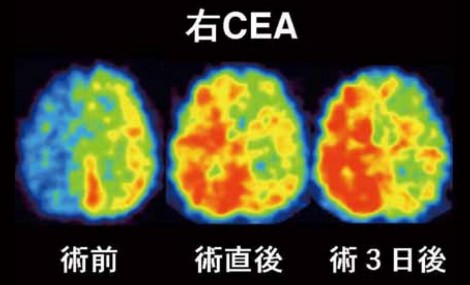
図7 右頸動脈内膜剥離術実施後のIMP-SPECT画像の変化
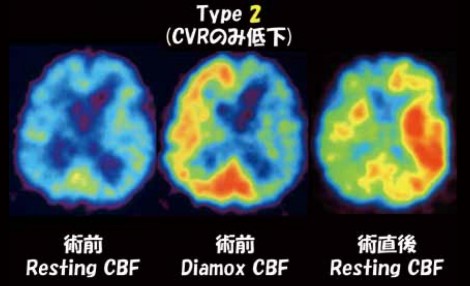
頸動脈内膜剥離術(Carotid endarterectomy:CEA)や頸動脈ステント術(Carotid artery stenting:CAS)後において、過灌流症候群などの重篤有害事象の発生予測にDiamox負荷脳血流SPECTが用いられる。しかしここでも、Diamox使用量は最小限にしなければならない。CEAを実施した患者の術前、術直後、術3日後のIMP-SPECT画像を図7に示す。これが典型的な過灌流である。過灌流が症候化すると最終的に脳内出血が起こり生命の危機に瀕する。内頸動脈が狭窄すると、同側大脳半球の灌流圧が低下し、自動調節能により脳血管が拡張する。この状態が慢性化したところで血行再建されると、同側大脳半球の灌流圧が急激に正常化するが、脳血管は拡張状態のままであるために結果的に血流が増える。これが過灌流の生じるプロセスである。血流は灌流圧と血管の拡張状態で決まるので、術前のDiamox反応性で血管の拡張状態が分かれば過灌流の予測ができる。ただ、過灌流がStage 1で起こるのかStage 2で起こるのかについては実は良く分かっていなかった。黒田分類では、CVRおよびCBFともに正常なものをType 1(≒Stage 0)、CVRのみ低下しているものをType 2(≒Stage 1)、両者ともに低下しているものをType 3( ≒Stage 2+3)、CBFのみ低下しているものをType 4(Stage 3)と定義している(図8)。この定義に基づいて、過灌流はどのタイプに起りやすいかを500例で検討したデータでは、Type 1およびType 4では1例も過灌流が生じておらず、両者が低下しているType 3ではもちろん過灌流を生じた症例が多かったが(46%)、CVRのみ低下しているType 2でも同様の頻度(42%)で過灌流が生じたことが分かった(図9)。このデータから、CVRの低下が過灌流のリスクであることが示唆され、約4割で術後過灌流を起こすと考えられる。
MRAによるグレード分類を用いた術後過灌流の予測
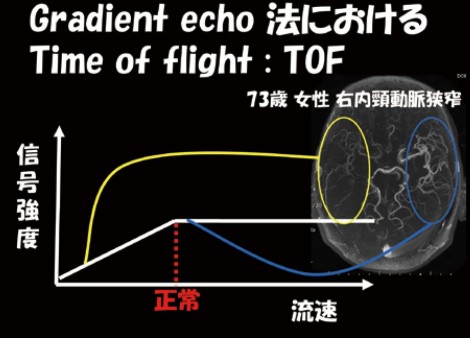
図10 gradient echo法におけるTOFの信号強度と流速の関係
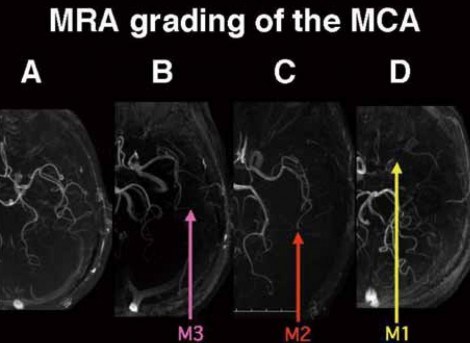
Diamox使用量を最小限にするための工夫として、MRAの活用が考えられる。例えばMRAにおいて内頸動脈の信号強度が低下していると一見脳循環が悪いと思えるが、実際にそうなのだろうか。実は、Gradient echo法におけるTOF(time of flight)の考え方ではMRIの信号強度は流速を示すもので、流速が低下するとMRIの信号強度が弱くなる(図10)。したがって、MRAにおいて信号強度が低下しているのは流速が低下していることを示唆するものと言える。そうだとすると、MRA上の信号強度と流速は正の相関にあり、流速とMTT(血液通過時間)は負の相関、MTTとCVRは負の相関にあるので、信号強度とCVRは正の相関関係にあると考えることができる。これを検証すべく、中大脳動脈のMRAでM1、M2、M3まで見える正常な状態(グレードA)からM1が見えない異常な状態(グレードD)まで4群に分類して(図11)、CVR18.4%をカットオフ値として比較したところ、グレードAでCVR正常は93%、グレードB、C、DでCVR低下は約51%で見られた。MRA所見に基づくグレード分類を術直後過灌流の予測に用いることができるかどうかを検討するため、81例を対象に3TのMRAでグレードを評価すると、グレードAの症例では1例も過灌流が起こらなかったのに対し、グレードB、C、Dになると3割程度の症例で過灌流が起こることが分かった。次に301例を対象として1.5TのMRAで評価すると、同様にグレードAでは1例も過灌流が起こらず、グレードB、C、Dでも2~3割の頻度で過灌流が起こる結果になった。これらのデータから、陽性的中率は低いが、過灌流が起こるものと起こらないものは十分区別できると考えられた。
以上のことから、CEAあるいはCASの適応がある症例において、MRAで中大脳動脈末梢の描出が正常であれば過灌流のリスクなしと判定できる。中大脳動脈末梢の描出が不十分であればDiamox負荷脳血流SPECT検査を施行するというフローチャートができる。MRAで中大脳動脈末梢の描出が不十分だった患者における過灌流の陽性的中率は20%だったが、Diamox負荷脳血流SPECTを実施することで陽性的中率は48%まで上がるというデータが得られておりDiamox負荷脳血流SPECTを実施する意義は大きい。但し、MRAで中大脳動脈末梢の描出が正常であれば、Diamox負荷脳血流SPECT検査は実施する必要がなく、このフローチャートを用いることにより、実際のDiamox使用量は半数程度に低減できると考えられるため、適正使用ガイドラインの遵守にもつながるだろう。
図11 MRA grading of the MCA